

Haemate
von Willebrand factor and coagulation factor VIII in combination
250 IU FVIII / 600 IU VWF injektio-/infuusiokuiva-aine ja liuotin, liuosta varten 250 IU/600 IU + 5 ML
| Tukkukauppa: | 170,00 € |
| Jälleenmyynti: | 230,36 € |
| Korvaus: | 0,00 € |
250 IU FVIII / 600 IU VWF injektio-/infuusiokuiva-aine ja liuotin, liuosta varten 500 IU/1200 IU+10 ML
| Tukkukauppa: | 340,00 € |
| Jälleenmyynti: | 445,41 € |
| Korvaus: | 0,00 € |
1000 IU FVIII / 2400 IU VWF injektio-/infuusiokuiva-aine ja liuotin, liuosta varten 1000 IU/2400 IU+15ML
| Tukkukauppa: | 680,00 € |
| Jälleenmyynti: | 860,11 € |
| Korvaus: | 0,00 € |
Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta 4.
Täs s ä pakkausselosteessa kerrotaan:
Mitä Haemate on ja mihin sitä käytetään
Mitä sinun on tiedettävä, ennen kuin käytät Haematea
Miten Haematea käytetään
Mahdolliset haittavaikutukset
Haematen säilyttäminen
Pakkauksen sisältö ja muuta tietoa
Haematen sisältämää ihmisen von Willebrand -tekijää ja ihmisen hyytymistekijä VIII:aa voidaan käyttää myös muiden kuin tässä pakkausselosteessa mainittujen sairauksien hoitoon. Jos sinulla on lisäkysymyksiä, käänny lääkärin, apteekkihenkilökunnan tai muun terveydenhuoltohenkilöstön puoleen ja noudata aina heidän ohjeitaan.
Hyytymistekijä VIII ja von Willebrand -tekijä ovat välttämättömiä veren hyytymisen kannalta. Haemate korvaa elimistön hyytymistekijä VIII:n ja von Willebrand -tekijän puutosta. Verenvuodot voidaan tällöin saada loppumaan tai ehkäistyksi.
Haematea käytetään ehkäisemään tai hoitamaan verenvuotoja niillä potilailla, jotka sairastavat:
von Willebrandin tautia, kun desmopressiinihoito ei ole riittävä
A-hemofiliaa (perinnöllinen hyytymistekijä VIII:n puutos)
hankinnaista hyytymistekijä VIII:n puutosta.
Haematea käytetään myös hyytymistekijä VIII -vasta-ainepotilaiden hoitoon.
Koska Haemate sisältää sekä hyytymistekijä VIII:aa (FVIII) että von Willebrand -tekijää (VWF), on tärkeää tietää, kumpaa näistä sinä tarvitset eniten. Jos sinulla on A-hemofilia, lääkäri määrää sinulle Haematea erityisesti määritettyinä hyytymistekijä VIII -yksikköinä. Jos sinulla on von Willebrandin tauti, lääkäri määrää sinulle Haematea erityisesti määritettyinä von Willebrand tekijän yksikköinä.
Jos olet allerginen von Willebrand -tekijälle tai hyytymistekijä VIII:lle tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa 6).
Jäljitettävyys
Joka kerta kun saat Haemate-hoitoa, valmisteen nimi ja eränumero kannattaa merkitä muistiin, jotta käytetty valmiste voidaan tarvittaessa jäljittää.
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät Haematea. Jos sinulla ilmenee yliherkkyysreaktio (katso oireet kohdasta 4. Mahdolliset haittavaikutukset), lopeta hoito ja ota yhteys lääkäriin.
A-hemofilia
Inhibiittorien (vasta-aineiden) muodostuminen on tunnettu komplikaatio, joka voi kehittyä minkä tahansa tekijä VIII-lääkkeen käytön aikana. Etenkin suurina pitoisuuksina esiintyessään nämä inhibiittorit estävät hoitoa vaikuttamasta oikein, ja sinua tai lastasi seurataan huolellisesti inhibiittorien kehittymisen varalta. Kerro lääkärille heti, jos verenvuotosi tai lapsesi verenvuoto ei ole hallittavissa Haemate-valmisteella.
Von Willebrandin tauti
Von Willebrand -tekijällä annetun hoidon yhteydessä voi kehittyä vasta-aineita hyytymistekijöille, mikä aiheuttaa sen, ettei verenvuotoa voi saada hallintaan tavanomaisten annosten avulla. Sen vuoksi on tärkeää, että lääkäri seuraa hoitosi tehoa.
Jos sinulla on todettu sydäntauti tai kuulut sydäntautien riskiryhmään, kerro asiasta lääkärille tai apteekkihenkilökunnalle.
Jos Haemate-valmisteen antaminen edellyttää keskuslaskimokatetrin asettamista, sinua hoitavan lääkärin on huomioitava keskuslaskimokatetriin liittyvien komplikaatioiden riski. Näitä komplikaatioita voivat olla mm. paikalliset infektiot, bakteerien esiintyminen veressä (bakteremia) ja verihyytymän (tromboosin) muodostuminen siihen verisuoneen, johon katetri on asetettu.
Jos sairastat von Willebrandin tautia, sinulla on suurentunut verisuonitukosten vaara (keuhkoveritulppa mukaan luettuna) Haemate-hoidon yhteydessä, etenkin jos sinulla on jokin tunnettu riskitekijä verisuonitukosten muodostumiselle, kuten esim. sinulla on aiemmin ollut verisuonitukoksia, et ole saanut verisuonitukoksia ehkäisevää hoitoa leikkauksen yhteydessä, olet hyvin ylipainoinen, olet ollut pitkään vuodepotilaana, sinulla on syöpä tai olet saanut yliannostuksen. Mikäli sinulla on jokin edellä mainituista riskitekijöistä, kysy ohjeita lääkäriltä ennen Haematen käyttämistä.
Valmisteen virusturvallisuus
Kun lääkevalmiste valmistetaan ihmisen plasmasta tai verestä, käyttöön otetaan erityisiä varotoimia, jotta voidaan estää tartuntojen siirtyminen potilaisiin. Tämä käsittää:
veren- ja plasmanluovuttajien tarkan valinnan, jolla varmistetaan, että tarttuvia tauteja mahdollisesti kantavat henkilöt suljetaan pois
jokainen luovutettu veriyksikkö ja plasmapooli testataan virusten/infektioiden merkkien varalta
virusten inaktivoinnin ja eliminoinnin veri- ja plasmavalmisteista osana valmistusprosessia.
Tästä huolimatta tarttuvien tautien siirtymistä ei voida sulkea täysin pois, kun annetaan ihmisen verestä tai plasmasta valmistettua lääkevalmistetta. Tämä koskee myös uusia, tähän saakka tuntemattomia viruksia ja muita taudinaiheuttajia.
Näiden toimenpiteiden katsotaan tehoavan vaipallisiin viruksiin, kuten HI-virukseen, hepatiitti B ja C -viruksiin sekä vaipattomaan hepatiitti A -virukseen.
Toimenpiteet saattavat tehota vain rajoitetusti vaipattomiin viruksiin, kuten parvovirukseen B19.
Parvovirus B19 -infektio saattaa olla vakava raskaana oleville naisille (sikiön infektio), potilaille, joiden immuunivaste on heikentynyt, tai tietyn tyyppistä anemiaa sairastaville (esim. hemolyyttinen anemia).
Lääkäri ehdottaa sinulle hepatiitti A ja B -rokotuksen ottamista, jos saat säännöllisesti/toistuvasti hoitoa hyytymistekijä VIII:aa/von Willebrand -tekijää sisältävillä plasmajohdannaisilla.
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden, laimentimien tai liuottimien kanssa.
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
Haematea tulee käyttää raskauden ja imetyksen aikana vain hoitavan lääkärin erityisen harkinnan mukaan.
Haemate-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haemate 250 IU FVIII/600 IU VWF sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan
sanoa olevan ”natriumiton”.
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä, jos olet epävarma.
Lääkäri aloittaa hoidon. Lääkäri antaa sinulle tarkat ohjeet liuoksen sekoittamisesta käyttövalmiiksi, injektio-/infuusiotekniikasta sekä toimenpiteistä, joihin tulee ryhtyä vakavan haittavaikutuksen ilmetessä. Heti kun pystyt huolehtimaan itse hoidostasi ja jos haittavaikutuksia ei ole ilmaantunut hoidon aikana, lääkäri voi antaa sinun jatkaa hoitoa kotona.
Lääkäri määrittelee sinulle sopivan annoksen. Älä muuta lääkärin määräämää annostusta tai injektionopeutta.
Yleiset valmistus- ja anto-ohjeet:
Liuoksen on oltava kirkasta tai hieman opaalinhohtoista. Suodattamisen/ruiskuun vetämisen jälkeen (ks. alla), mutta ennen antoa, liuos on tarkistettava silmämääräisesti, ettei siinä ole havaittavissa hiukkasia eikä värjäytymiä. Vaikka käyttövalmiiksi sekoittamisessa seurattaisiin ohjeita tarkoin, suodattamattomaan liuokseen saattaa jäädä hiukkasia tai partikkeleita. Mix2Vial-laitteen suodatin poistaa kaikki nämä hiukkaset. Älä käytä liuosta, jos se on edelleen sameaa tai siinä on hiukkasia tai partikkeleita nähtävissä vielä suodatuksen jälkeen.
Käyttövalmiiksi sekoittaminen ja ruiskuun vetäminen on tehtävä aseptisissa olosuhteissa (estää bakteerien pääsyn valmisteeseen).
Liuos on käytettävä välittömästi ruiskuun vetämisen jälkeen.
Liuoksen sekoittaminen käyttövalmiiksi ja ruiskun täyttäminen
Lämmitä liuos huoneenlämpöiseksi. Poista muovikorkki sekä Haemate- että liuotinpullosta. Pyyhi kumitulppien pinnat antiseptisellä liuoksella ja anna niiden kuivua ennen Mix2Vial-pakkauksen avaamista.


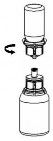


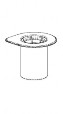
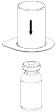
1 | 1. Avaa Mix2Vial-pakkaus vetämällä suljin auki. Älä poista Mix2Vial-laitetta läpipainopakkauksesta. | ||
2 | 2. Aseta liuotinpullo tasaiselle, puhtaalle alustalle ja ota pullosta tukeva ote. Ota Mix2Vial- läpipainopakkaus ja paina sinisen sovittimen kärki suoraan alas liuotinpullon korkin läpi. | ||
3 | 3. Poista varovasti Mix2Vial-laitteen läpipainopakkaus pitämällä kiinni reunasta ja vetämällä kohtisuoraan ylöspäin. Katso, että poistat vain läpipainopakkauksen etkä Mix2Vial- laitetta. | ||
4 | 4. Aseta Haemate-pullo tasaiselle ja kovalle alustalle. Käännä liuotinpullo ja siihen kiinnitetty Mix2Vial-laite ylösalaisin ja paina läpinäkyvän sovittimen kärki suoraan alas Haemate-pullon korkin läpi. Liuotin valuu automaattisesti Haemate-pulloon. | ||
5 | 5. Ota toisella kädellä ote Mix2Vial-laitteen osasta, johon Haemate-pullo on kiinnitetty, ja toisella kädellä kiinni Mix2Vial-laitteen osasta, johon liuotinpullo on kiinnitetty, ja kierrä laite varovasti irti kahteen osaan varoen vaahdon muodostumista. Hävitä liuotinpullo ja siinä kiinni oleva sininen Mix2Vial-osa. | ||
6 | 6. Pyöritä varovasti Haemate-pulloa, jossa on läpinäkyvä sovitin, kunnes kuiva-aine on liuennut täysin. Älä ravista pulloa. |
7 | 7. Vedä tyhjään steriiliin ruiskuun ilmaa. Ruisku kiinnitetään Mix2Vial-laitteeseen Luer Lock - liittimen avulla, kun Haemate-pullo on pystyasennossa. Ruiskuta ilma Haemate-pulloon. |
8 | 8. Kun ruiskun mäntä on sisään painettuna, käännä pullo (sekä laite että ruisku) ylösalaisin. Vedä liuosta ruiskuun vetämällä mäntää hitaasti ulospäin. | ||
9 | 9. Kun kaikki liuos on siirtynyt ruiskuun, ota ote ruiskusta (pidä ruiskua mäntä alaspäin) ja irrota läpinäkyvä Mix2Vial-sovitin ruiskusta. |

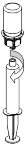
Anna liuos heti injektiosetin avulla hitaana injektiona laskimoon nopeudella, joka tuntuu miellyttävältä (enintään 4 ml/min). Tarkista, ettei täyteen ruiskuun tule verta.
Jos tarkoitus on antaa suurempi määrä lääkettä, se on annettava infuusiona (tiputuksena laskimoon). Useista injektiopulloista valmiiksi saatettu liuos siirretään tällöin sopivaan infuusiopussiin tai infuusiopumppuun. Jos lääke annetaan sinulle infuusiona, niin lääkkeen antaa sinulle terveydenhuollon ammattilainen.
Jos olet ottanut liian suuren lääkeannoksen tai vaikkapa lapsi on ottanut lääkettä vahingossa, ota aina yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (puh. 0800 147 111) riskien arvioimiseksi ja lisäohjeiden saamiseksi.
Ota välittömästi seuraava annos ja jatka säännöllisin välein lääkärin ohjeen mukaan. Älä ota kaksinkertaista annosta korvataksesi unohtamasi annoksen.
Älä lopeta Haematen käyttöä kysymättä neuvoa lääkäriltä.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan saa niitä.
kasvojen, kielen tai nielun turvotusta
nielemisvaikeuksia
nokkosihottumaa ja hengitysvaikeuksia
kutina, hengenahdistus, painon tunne rinnassa, alhainen verenpaine, nesteen kertyminen ihoon ja limakalvoihin, polton tunne/kirvely injektiopaikassa, vilunväreet, lämmöntunne, päänsärky, sydämentykytys, pahoinvointi, horrostila, rauhattomuus, pistely ja oksentelu. Jos saat yliherkkyysreaktion, keskeytä hoito ja ota yhteys lääkäriin.
Harvinaiset (harvemmin kuin 1 potilaalla 1000:sta):
Kuume.
Verisuonitukokset, keuhkoveritulppa mukaan luettuna. Riski on suurentunut niillä von Willebrandin tautia sairastavilla potilailla, joilla on tunnettuja riskitekijöitä, ks. Varoitukset ja varotoimet.
Von Willebrand tekijän vasta-aineet – ks. Varoitukset ja varotoimet.
Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin)
Hemolyysi (punasolujen hajoaminen)
Hypervolemia (veren suurentunut tilavuus).
Haittavaikutukset lapsilla ja nuorilla
Lapsilla esiintyvät haittavaikutukset ovat oletettavasti samanlaisia kuin aikuisilla.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, sairaanhoitajalle tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla).
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä ulkopakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen (EXP). Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä alle 25 C. Ei saa jäätyä. Pidä pakkaus ulkopakkauksessa. Herkkä valolle. Käyttövalmiiksi sekoitettu liuos tulee käyttää välittömästi.
Älä käytä liuosta, jos se on edelleen sameaa tai siinä on hiukkasia tai partikkeleita nähtävissä vielä suodatuksen jälkeen.
Käyttämätön käyttövalmiiksi sekoitettu liuos on hävitettävä.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Vaikuttavat aineet ovat:
Ristosetiinikofaktori (VWF:RCo) ihmisen plasmajohdannainen von Willebrand -tekijä 600 IU (kansainvälistä yksikköä).
Ihmisen hyytymistekijä VIII 250 IU.
Muut aineet kuiva-aineessa ovat ihmisen albumiini, glysiini, natriumkloridi, natriumsitraatti, natriumhydroksidi tai kloorivetyhappo (pH:n säätöön).
Liuotin on injektionesteisiin käytettävää vettä.
Kuiva-aine on valkoista tai heikosti kellertävää. Neste on väritön ja kirkas.
Pakkauskoot:
250 IU hyytymistekijä VIII:a / 600 IU von Willebrand -tekijää: 1 x (kuiva-aine ja 5 ml liuotinta)
Rasian sisältö:
1 injektiopullo, joka sisältää kuiva-ainetta
1 injektiopullo, joka sisältää liuotinta (5 ml)
1 siirtosetti, jossa suodatin 20/20 Annostelutarvikkeet (sisärasia):
1 kertakäyttöruisku, 5 ml
1 injektiosetti
2 alkoholipyyhettä
1 laastari
CSL Behring GmbH, Emil-von-Behring-Str. 76, 35041 Marburg, Saksa
CSL Behring, PL 712, 182 17 Danderyd, Ruotsi